MDR Regolamento sui dispositivi medici (UE 2017/745)
Corrisponde alla configurazione attuale, inclusa l'attuale proroga ai sensi del regolamento UE 2023/607
Questi contenuti sono stati redatti da Beurer GmbH. Non garantiamo l'esattezza, la completezza e l'aggiornamento di tali informazioni.
Escludiamo qualsiasi responsabilità per danni di qualsiasi tipo causati dall'utilizzo dei dati forniti, a meno che non ci venga dimostrato un comportamento intenzionale o di grave negligenza.
Cos'è l'MDR?
A partire dal 26 maggio 2021, il nuovo regolamento UE sui dispositivi medici (MDR – Medical Device Regulation (UE 2017/745)) è obbligatorio e sostituisce la direttiva sui dispositivi medici esistente (Medical Device Directive (93/42/CEE)).
Il MDR disciplina l'omologazione dei dispositivi medici, come misuratori di pressione, termometri per febbre, ecc. e allinea la legislazione UE con lo sviluppo tecnico e le trasformazioni della scienza medica in materia di normative.
Ne derivano diversi obblighi e regole per tutti i partecipanti della catena del valore, che devono essere presi in considerazione e implementati sotto la propria responsabilità.
Desideriamo pertanto informarvi su cosa questo significhi per voi per quanto riguarda la vostra collaborazione con Beurer e in qualità di distributore dei nostri prodotti.
Beurer si occupa di garantire che i propri dispositivi medici vengano adattati tempestivamente dalla MDD al MDR. Potete quindi continuare a ordinare in tutta tranquillità i prodotti presso Beurer.
Per evitare interruzioni commerciali e agevolare la transizione dalla direttiva alle norme del regolamento, sono previste diverse disposizioni transitorie.
Termini per l'attuazione dell'MDR
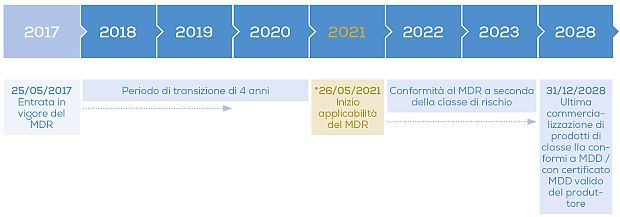
Avviso: Tutti i prodotti messi in commercio prima del 31/12/2028 (ad es. presso i rivenditori in magazzino) possono continuare ad essere venduti senza ulteriori proroghe.
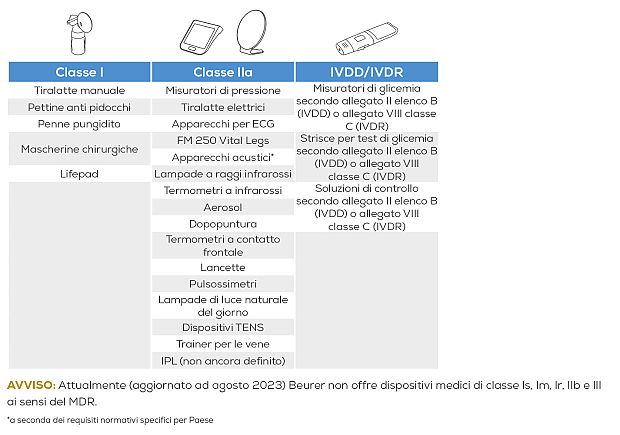
I glucometri, le strisce reattive e le soluzioni di controllo della glicemia rientrano nell'allegato II elenco B (IVDD = In Vitro Diagnostic Directive) o nell'allegato VIII classe C (IVDR = In Vitro Diagnostic Regulation).
Il IVDR è entrato in vigore con il MDR il 25 maggio 2017 ed è valido dal 26 maggio 2022.
* Il 17/04/2020 il Parlamento europeo ha deciso di posticipare di un anno l'entrata definitiva in vigore a causa della pandemia di Covid-19.
Corrisponde alla configurazione attuale, inclusa l'attuale proroga ai sensi del regolamento UE 2023/607
Who is who?
Nel rapporto con Beurer, mantenete sempre il ruolo di distributore. Con il MDR si aggiungono ora ulteriori obblighi e compiti dei quali vorremmo informarvi.
Se il distributore cede il prodotto a un rivenditore, dovrà fornire la dichiarazione CE anche a questo. Questo rivenditore fa quindi parte della catena di fornitura e ha obblighi identici a quelli del distributore.
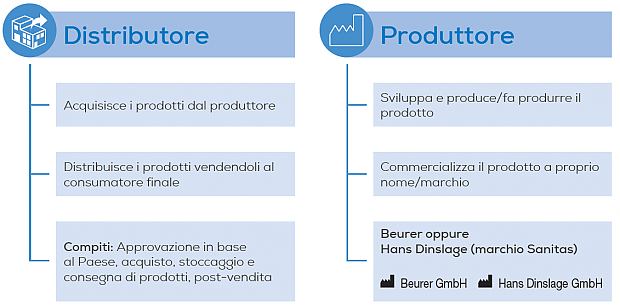
Panoramica - Obblighi del distributore
I distributori si assicurano a campione che i dispositivi medici distribuiti soddisfino i requisiti di cui all'art. 14 del Regolamento sui dispositivi medici.
Verifica del prodotto e dei documenti (ai sensi dell'art. 14 (2) del MDR)
- Il prodotto ha marchio CE
- È presente la dichiarazione di conformità CE. Se la dichiarazione di conformità non è presente, può essere scaricata gratuitamente dalla homepage Beurer.
- Le etichette e le istruzioni per l'uso sono disponibili nelle lingue degli Stati membri in cui il prodotto è commercializzato (o nelle lingue accettate in tali Stati membri).
- Il nome del produttore è indicato sul prodotto o su un documento allegato.
- NOVITÀ! Il prodotto potrebbe avere un UDI (durante certi periodi di transizione il prodotto non ha necessariamente un UDI, ma è comunque un dispositivo medico, vedere la spiegazione "Unique Device Identification – UDI").
Garanzia delle condizioni di conservazione e di trasporto raccomandate dal produttore (ai sensi dell'art. 14 (3) del MDR)
- Come per i dispositivi medici conformi alla MDD, è necessario attenersi alle condizioni di conservazione e di trasporto riportate sulla confezione e nelle istruzioni per l'uso.
Procedura di segnalazione e documentazione (ai sensi dell'art. 14 (2) – (6) del MDR)
- Nel caso in cui un prodotto non sia conforme al rispettivo regolamento, la distribuzione del prodotto è vietata.
- In caso di sospetta deviazione di un prodotto dal presente regolamento, il distributore dovrà informare immediatamente il produttore (vedi Indirizzi di assistenza).
- Esiste l'obbligo di informare le autorità e gli altri operatori economici (produttori e altri operatori della catena di fornitura) in caso di sospetto di contraffazione o di grave pericolo derivante dal prodotto.
- NOVITÀ! I distributori conservano un registro dei reclami, dei prodotti non conformi e dei richiami.
- I distributori collaborano con le autorità locali per fornire tutte le informazioni, i documenti e i campioni di prodotto a loro disposizione.
- I distributori comunicano immediatamente al produttore eventuali reclami o segnalazioni di sospetti incidenti in relazione a un prodotto fornito.
Gli indirizzi di contatto aggiornati per i prodotti Beurer e Sanitas sono reperibili a pagina 11 nella sezione "Download e indirizzi di contatto".
Documentazione della catena di fornitura
- da chi è stato acquistato e a chi è stato consegnato il prodotto?
- con la consegna ai pazienti o a un cliente finale privato decade l'obbligo di documentazione del distributore (Art. 10 (8) del MDR).
Unique Device Identification

UDI sta per Unique Device Identification, cioè identificazione univoca del dispositivo. Con il MDR è stato introdotto il nuovo requisito che prevede che in futuro tutti i dispositivi medici dovranno avere questo codice.
Il sistema UDI contribuirà a migliorare l'identificazione e la tracciabilità dei dispositivi medici. Tutte le informazioni vengono fornite sia sotto forma di testo semplice (lettere e numeri) che in formato leggibile da dispositivo (codice a barre o codice a matrice).
Attraverso l'UDI in futuro sarà possibile fare riferimento a un dispositivo su base individuale. Ciò è rilevante per i distributori solo in caso di ritiro.
Come riconosco un dispositivo medico?
1.0 Elenco dei dispositivi medici
Il dispositivo si trova nell'elenco dei dispositivi medici di Beurer (vedere pagina 9)?
2.0 Etichetta
Un dispositivo medico è riconoscibile quando 2.1 e 2.2 sono applicabili.
2.1 Marchio CE
Dispositivo medico Cl. I: Marchio CE senza codice a 4 caratteri
Dispositivi medici Cl. IIa/IIb: Marchio CE con codice a 4 caratteri
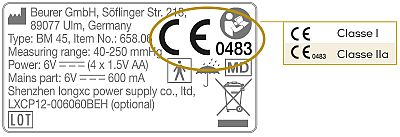
2.2 Simbolo "MD"
Se l'etichetta riporta il simbolo "MD", si tratta di un dispositivo medico conforme all'MDR.

3.0 Istruzioni per l'uso
"L'apparecchio è conforme ai requisiti della direttiva europea per i dispositivi medici 93/42/CEE, alla legge sui dispositivi medici, nonché [...]"
oppure
"L'apparecchio è conforme al regolamento (UE) 2017/745 del Parlamento europeo e del Consiglio relativo ai dispositivi medici, e alle rispettive disposizioni nazionali [...]"
Quali prodotti di Beurer/Sanitas sono dispositivi medici?
FAQ
Quali prodotti Beurer sono interessati all'MDR e quali sono le scadenze importanti?
I dispositivi medici sono suddivisi in quattro classi a seconda della durata di utilizzo, del grado di invasività o di riutilizzo: I, IIa, IIb e III.
Le classi Is, Im, Ir, IIa, IIb, III richiedono una valutazione e una certificazione da parte di un organismo di notifica ("Notified Body"). Le certificazioni rilasciate secondo l'attuale MDD continueranno a essere valide fino al termine indicato.
Beurer ha rinnovato le certificazioni nel 2019, quindi i prodotti certificati sono omologati fino al 26 maggio 2024 secondo la MDD.
I prodotti di classe I non necessitano finora di un certificato; dovranno essere conformi all'MDR a partire dal 26 maggio 2021.
INDICAZIONE:
Fino al 26 maggio 2025, i prodotti già in commercio (ad esempio, a magazzino presso i distributori) potranno essere distribuiti.
A partire da maggio 2021 riceverò ancora tutti i prodotti acquistati fino a quel momento?
Per i produttori la certificazione necessaria dei dispositivi medici secondo l'MDR richiede un grande sforzo. Ciò significa che a causa di tale onere in termini di tempo ed economicità i prodotti noti potranno non essere più disponibili per i distributori.
Tuttavia, Beurer adatterà tutti i prodotti di classe I secondo le disposizioni dell'MDR entro maggio 2021.
Tutti i prodotti di livello superiore scelti saranno adattati secondo l'MDR entro il 26 maggio 2024.
Entro e non oltre il 26 maggio 2025 potranno quindi essere distribuiti dispositivi medici in conformità con l'MDD/certificato MDD in vigore che sono già stati immessi sul mercato (ad es. a magazzino presso i distributori).
Saremo lieti di aiutarvi in caso di ulteriori domande sul tema MDR. Contattare:: mdr-info@beurer.de
Cosa devo documentare esattamente come distributore nell'ambito dell'MDR?
Documentazione per almeno 10 anni (MDR Art. 10, Sezione 8) del percorso effettuato dai prodotti:
- Da chi ho acquistato il dispositivo medico?
- A chi è stato consegnato il dispositivo medico?
INDICAZIONE:
Con la consegna al paziente o a un consumatore privato, decade l'obbligo di documentazione sopra descritto
- In caso di vendita di un prodotto in farmacia,questo non deve registrare né memorizzare idati del cliente finale.
L'MDR prescrive la documentazione anche in caso di consegna a strutture sanitarie (ad es. cliniche, ambulatori medici o case di cura), ma allo stato attuale questo non è ancora chiarito in via definitiva (art. 25, sezione 2c).
Dove posso trovare ulteriori informazioni sull'MDR?
Per ulteriori informazioni, visitate la seguente pagina Web dell'UE "Getting ready for the new regulations":
https://ec.europa.eu/growth/sectors/medical-devices/regulatory-framework/getting-ready-new-regulations
La seguente sezione è specifica per distributori e importatori:
https://ec.europa.eu/growth/sectors/medical-devices/getting-ready-new-regulations/authorised-representatives-importers-and_en
Database europeo dei dispositivi medici - EUDAMED
- Piattaforma centrale per tutte le informazioni su produttori, prodotti, certificati e analisi cliniche
- Diritti di accesso non ancora chiariti
- Pubblicazione e riempimento graduali
- https://ec.europa.eu/growth/sectors/medical-devices/new-regulations/eudamed_en
- https://ec.europa.eu/tools/eudamed/#/screen/home
Download e indirizzi di notifica per Beurer e Sanitas
Dichiarazioni di conformità CE per i prodotti Beurer:
https://www.beurer.com/mdr
Dichiarazioni di conformità CE per i prodotti Sanitas:
http://sanitas-online.de/web/de/landingpages/cedeclarationofconformity.php
Indirizzo di notifica attuale per i prodotti Beurer:
Per informazioni aggiornate sugli indirizzi di notifica nel Paese di riferimento per i prodotti Beurer, visitare: www.beurer.com –> Service –> Indirizzi di assistenza internazionali.
https://www.beurer.com/web/de/service/internationale-serviceadressen.php
Indirizzo di notifica attuale per i prodotti Sanitas:
E-Mail: service@sanitas-online.de
A partire dal 26 maggio 2021, il nuovo regolamento UE sui dispositivi medici MDR (Medical Device Regulation) è obbligatorio. Il MDR disciplina l'omologazione dei dispositivi medici e allinea la legislazione UE con lo sviluppo tecnico e le trasformazioni della scienza medica in materia di normative. Desideriamo pertanto informarvi su cosa questo significhi per voi per quanto riguarda la vostra collaborazione con Beurer e in qualità di distributore dei nostri prodotti.
